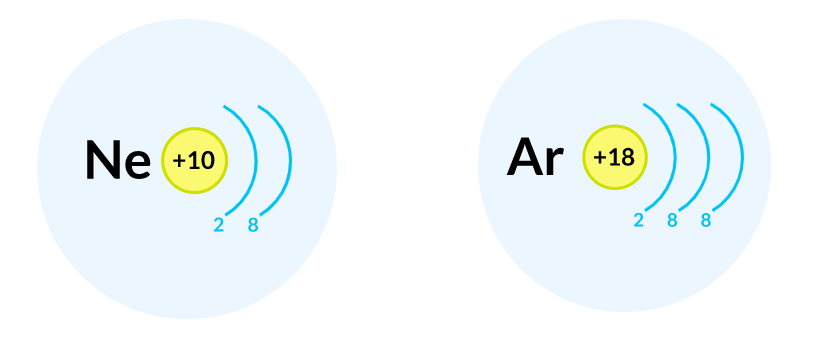
Электронные схемы атомов бериллия углерода и неона
§ 2. Строение электронных оболочек атомов
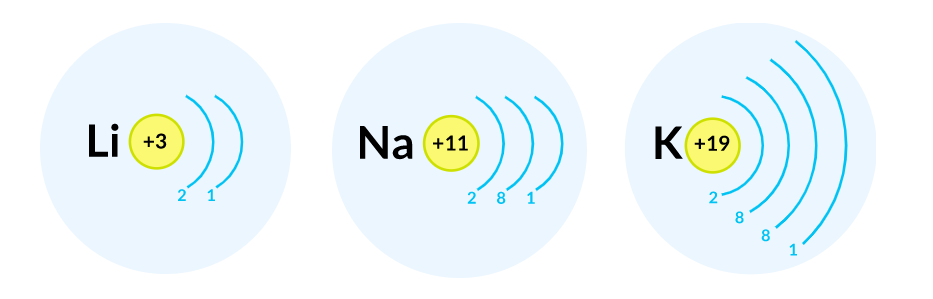
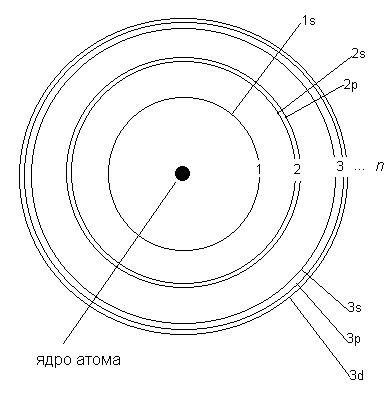
Наиболее простой способ - запись по электронным оболочкам. При этом указываются заряд ядра и количество электронов на каждой электронной оболочке по мере увеличения ее номера. Максимальное число электронов на n -й электронной оболочке равно 2n 2. Тода на 1-й оболочке может разместиться максимум 2 электрона, а на второй не более 8. При этом удаляют электрон с внешней электронной оболочки. Этот метод записи электронных конфигураций используют наиболее часто.



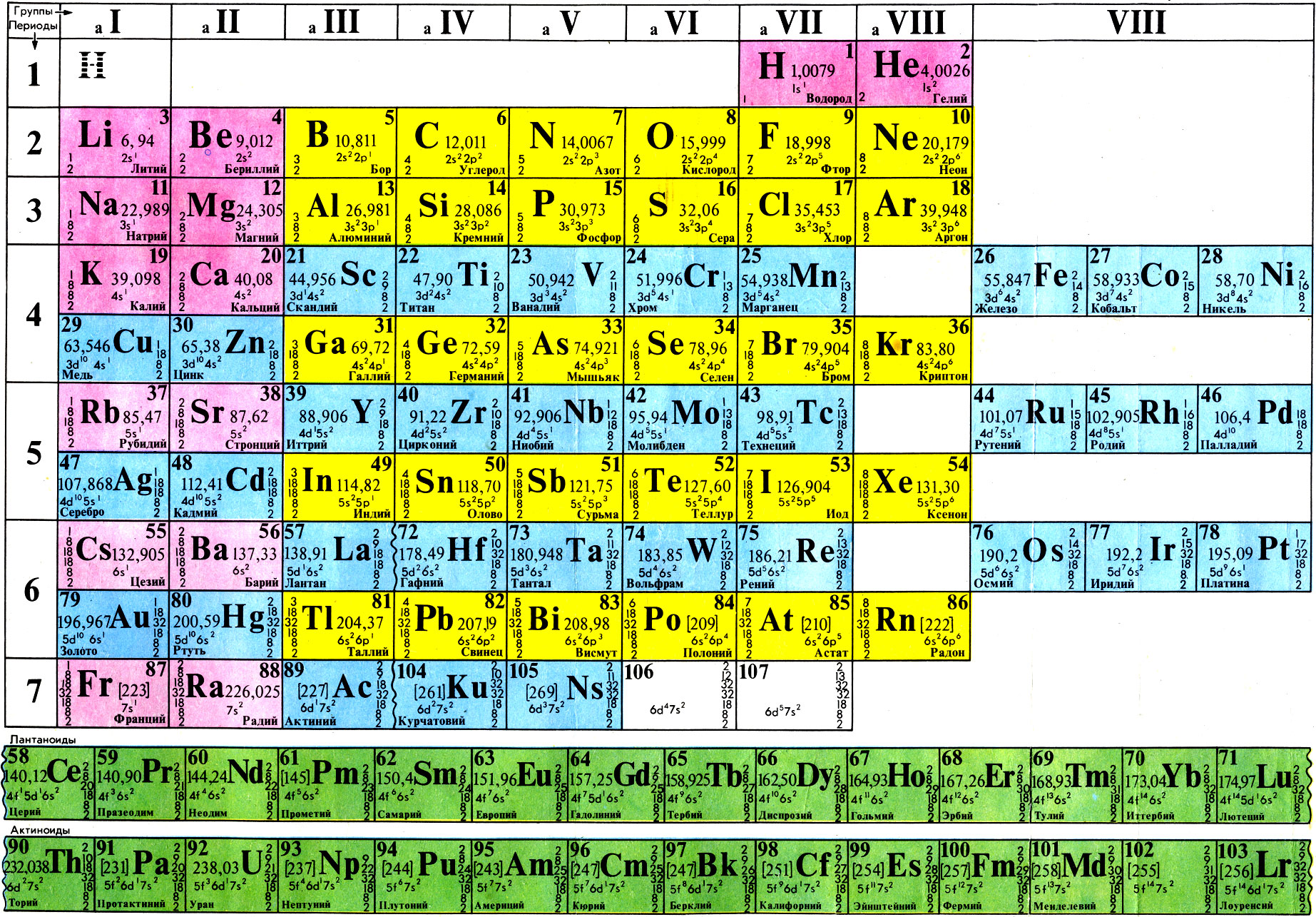
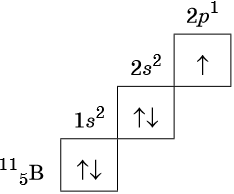
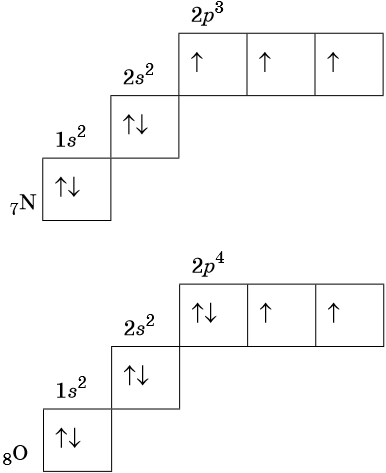
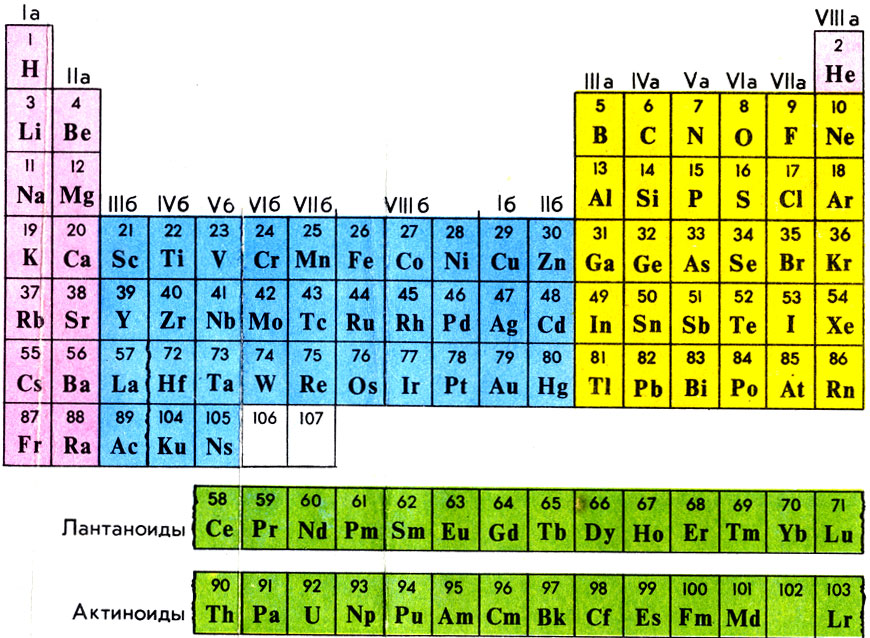
Строение периодической таблицы основано на строках для иллюстрации повторяющихся периодических трендов в химических свойствах элементов при увеличении атомного числа : новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Второй период содержит больше элементов, чем предыдущий , в него входят: литий , бериллий , бор , углерод , азот , кислород , фтор и неон. Данное положение объясняется современной теорией строения атома. Литий Li является химическим элементом с атомным номером 3, встречающимся в двух изотопах: 6 Li и 7 Li.
- 3. Бета-распад
- Строение периодической таблицы основано на строках для иллюстрации повторяющихся периодических трендов в химических свойствах элементов при увеличении атомного числа : новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Второй период содержит больше элементов, чем предыдущий , в него входят: литий , бериллий , бор , углерод , азот , кислород , фтор и неон.
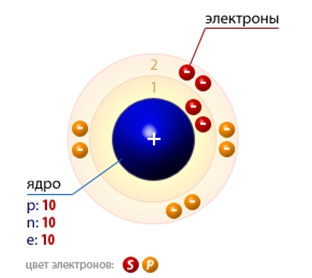
- Со школьного курса физики мы знаем, что атом имеет ядро из протонов и нейтронов, а вокруг вращаются электроны.
- Электронные конфигурации атомов химических элементов Знание возможных состояний электрона в атоме, правило Клечковского, принцип Паули и правило Гунда позволяют рассмотреть электронную конфигурацию атома.
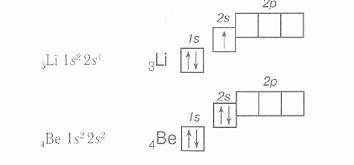


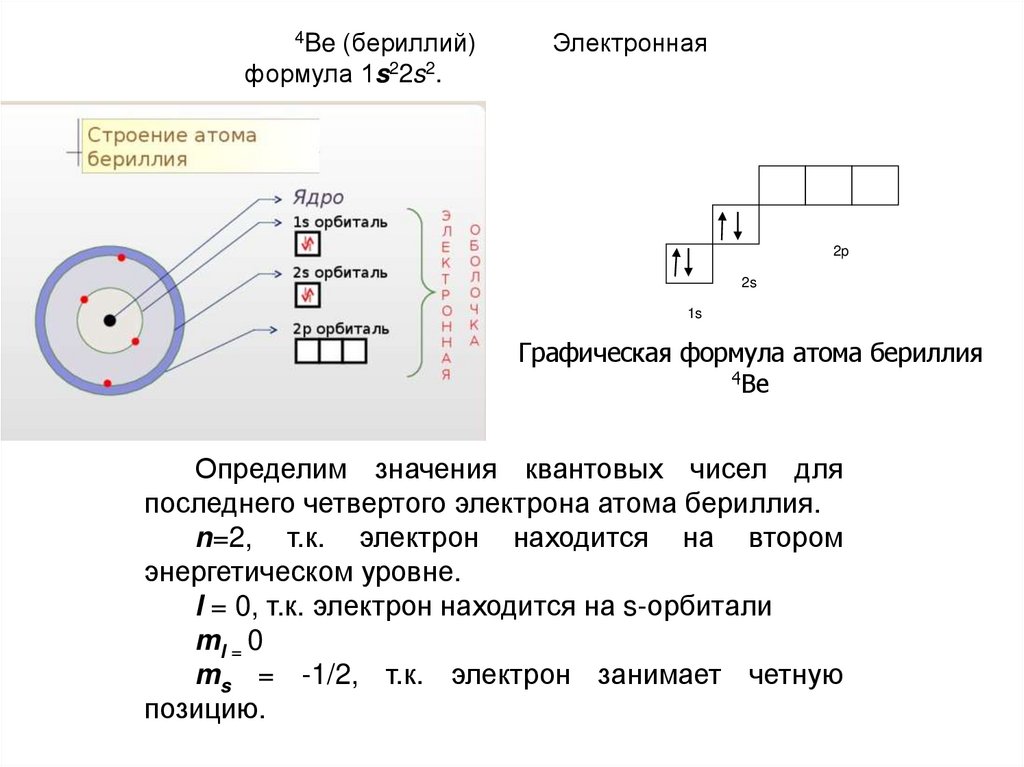
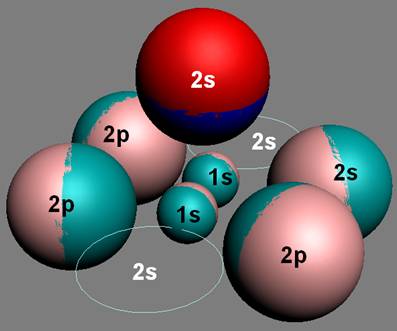
Электронная конфигурация атома бериллия Be. Be бериллий - элемент с прядковым номером 4 в периодической системе. Находится во II периоде. Плотность : 1. Электронная формула атома бериллия: 1s 2 2s 2 Сокращенная электронная конфигурация Be: [He] 2s 2. Ниже приведена электронно-графическая схема атома бериллия.