Электронные схемы и электронные формулы
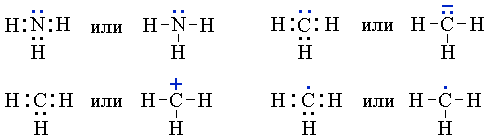
Электронные формулы атомов химических элементов (109)
Мы приступаем к изучению химии - мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов. Атом греч.



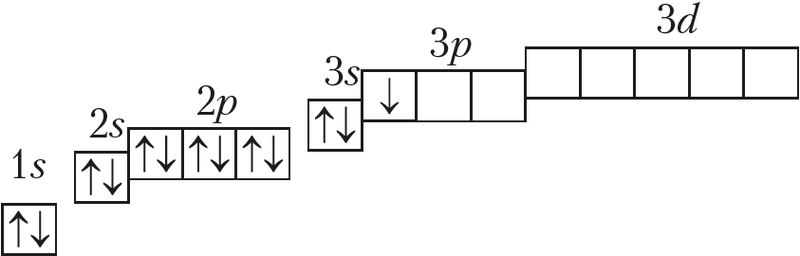




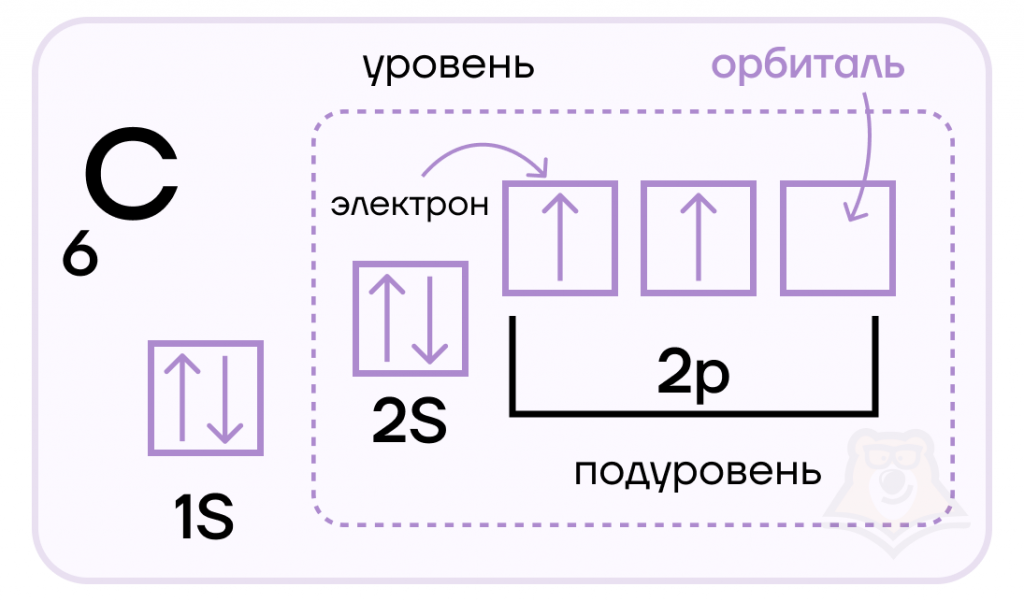
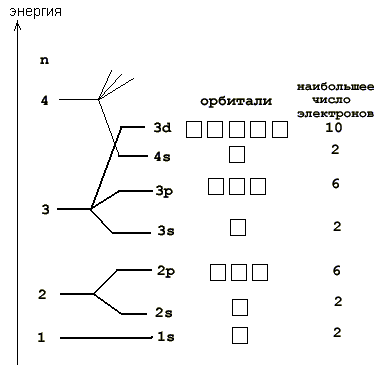
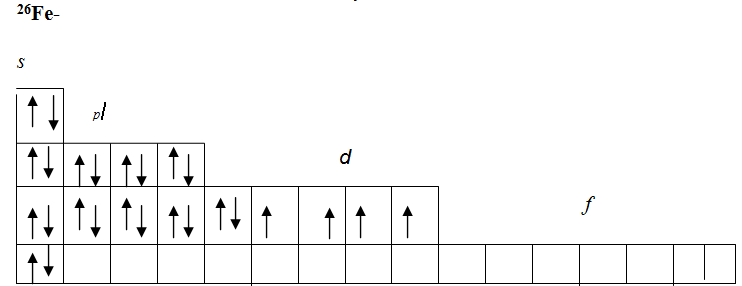
В атоме не может быть даже двух электронов, у которых все четыре квантовых числа n , l , m s , m l были бы одинаковыми. При устойчивом невозбужденном состоянии атома абсолютное значение суммарного спина электронов в пределах энергетического подуровня должно быть максимальным то есть орбитали данного подуровня заполняются сначала неспаренными электронами. Например, возьмем р-подуровень, на трех орбиталях которого надо разместить три электрона.
- Электронные конфигурации элементов со 105 по 118
- Постройте электронно-графические схемы и запишите электронные формулы атомов химических элементов 3-го периода.
- Регистрация Вход.
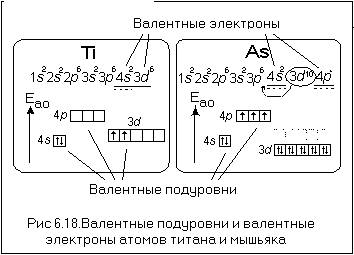
- Составьте электронные формулы и графические схемы, отражающие порядок распределения электронов по орбиталям в атомах фосфора и титана. Определите: а к каким элементам s-, р-, d-, f- они принадлежат; б какие подуровни занимают валентные электроны этих атомов.
- На этой странице показаны электронные конфигурации нейтральных атомов в их основных состояниях. Для каждого атома подоболочки даны сначала в краткой форме, затем со всеми выписанными подоболочками, за которыми следует число электронов на оболочку.
- Окружающие нас тела состоят из мельчайших частиц — атомов. Интересно узнать, какова же структура этих «кирпичиков» Мироздания?
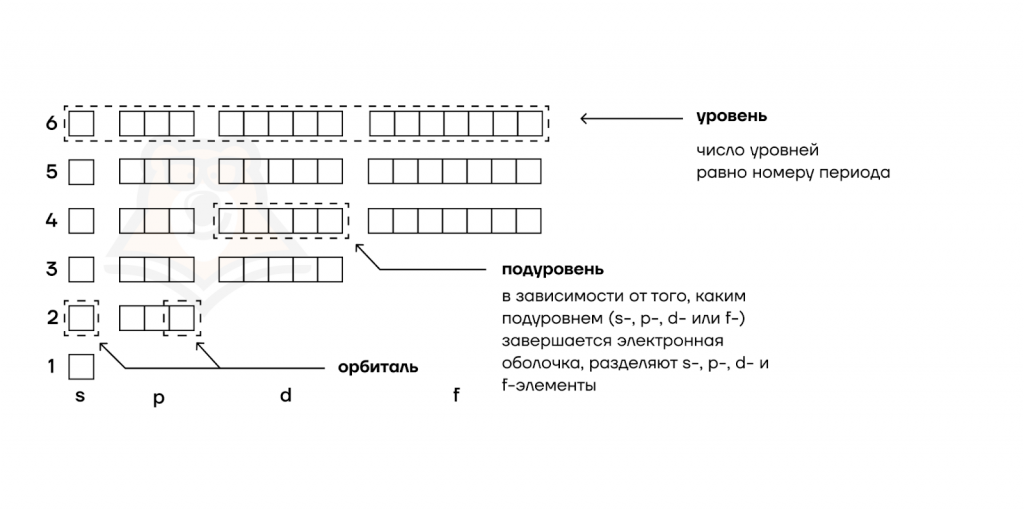
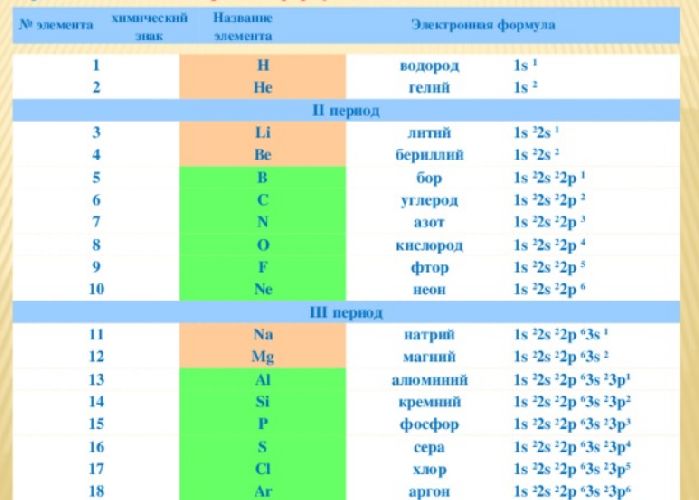
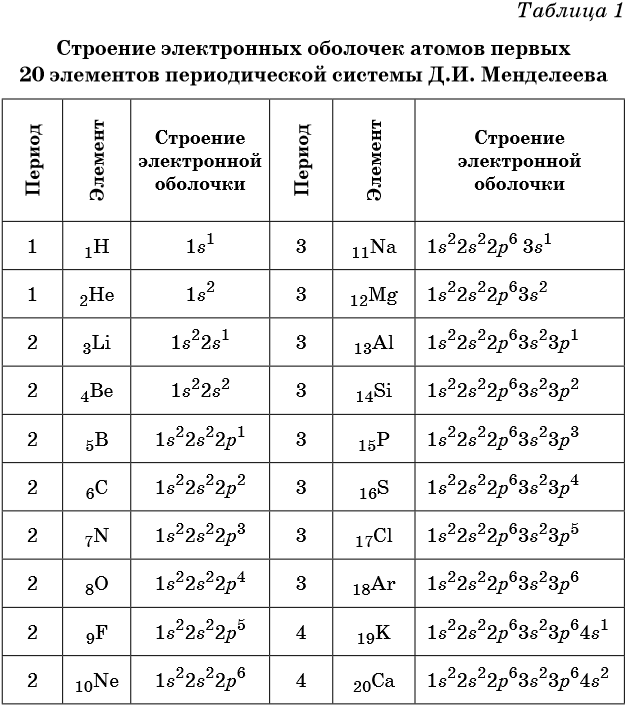
- Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов.
- Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего».
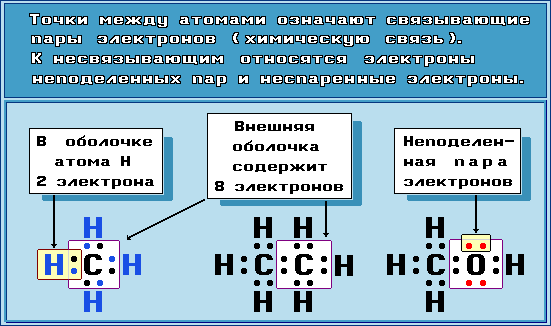
- Электронная конфигурация формула атома отражает, как электроны распределены по различным энергетическим уровням и подуровням в атоме, а также предоставляет информацию о состоянии конкретного электрона в атоме. Такая формула является ключом к пониманию химических свойств элементов, и она определяет их способность к образованию химических связей и взаимодействию с другими атомами.
- Рубрика: ЕГЭ - химия для чайников.



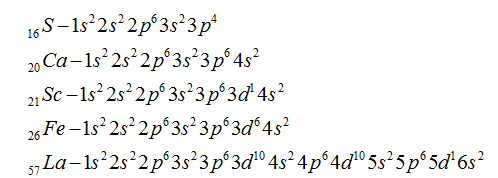

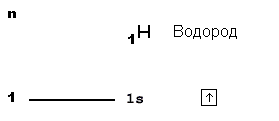
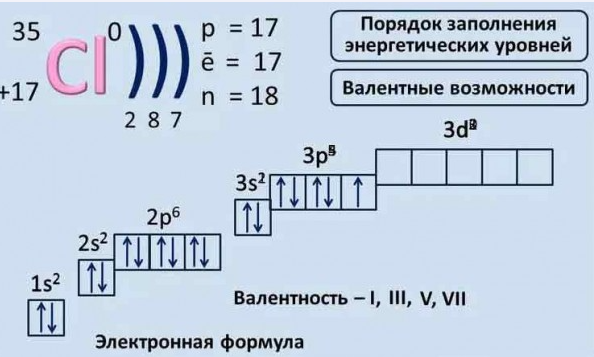


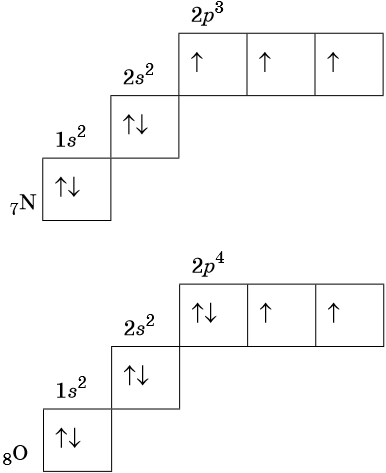
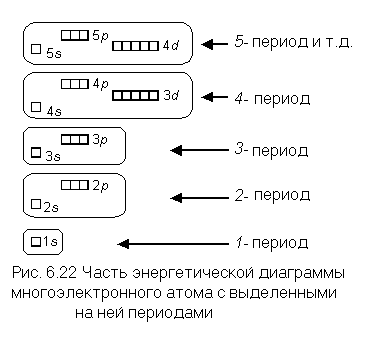
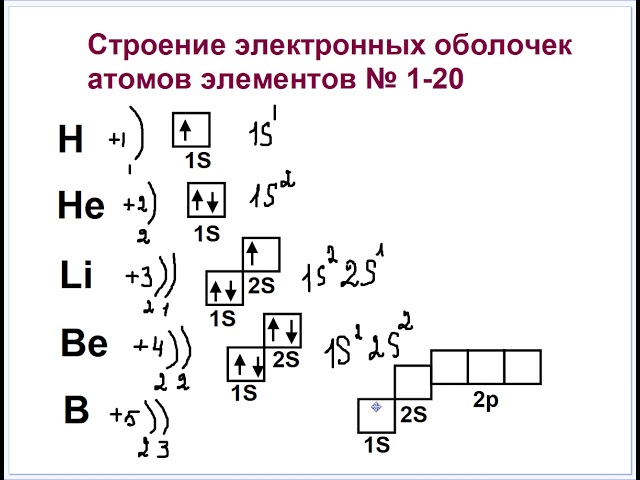
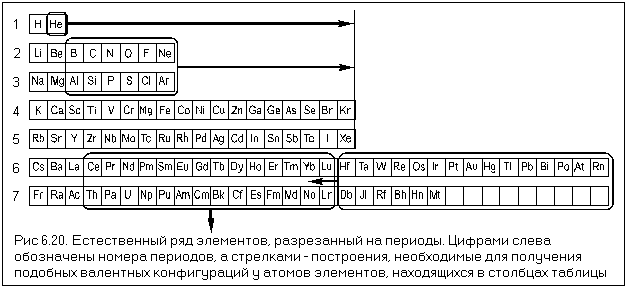
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского. Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.